可变形液态金属在生物医学、柔性电子和微纳马达等领域的应用至关重要。与刚性微纳米金属材料相比,柔性微纳米液态金属拥有更强的顺应性和易于调控等特性。在生物医学领域,常规纳米颗粒面临“尺寸困境”:小尺寸颗粒易于细胞穿透但滞留时间短,大尺寸颗粒虽滞留时间长但难以高效进入细胞。如何实现“既进得去,又留得住”成为纳米药物设计的关键难题。
近日,中国科学院理化技术研究所在可变形液态金属纳米颗粒(LMPs)的细胞内外动态行为机制研究中取得重要进展。该研究从理论及实验层面揭示了液态金属纳米颗粒在肿瘤微环境中的靶向自组装、细胞内自融合及溶酶体逃逸全链条动态作用机制,为新一代智能纳米药物设计提供了新思路(图1)。
理化所低温科学与技术全国重点实验室液态金属与低温生物医学研究中心利用液态金属材料变形特性与自组装肽修饰设计,使LMPs具备独特的“动态变形能力”。在细胞膜层面,可变形液态金属纳米颗粒可实现主动靶向与自组装,强化了微观定向传质效果,显著提升了肿瘤细胞对其的内吞效率(图2)。进入溶酶体后,酸性/酶微环境作用使得液态金属氧化膜逐渐消失从而触发金属颗粒的自融合,实现“先小后大”的细胞内尺寸跃迁。研究团队对该过程进行了深入的数理计算和透射电镜微观对比分析,将融合过程划分为惯性限制粘性阶段、过渡阶段以及惯性控制阶段,为持续线粒体应激与诱导细胞死亡效应放大提供了结构基础(图3)。从溶酶体逃逸后,可变形液态金属颗粒持续释放的镓离子进一步介导了线粒体损伤机制,释放的Ga³⁺通过铁替代途径破坏线粒体铁硫簇组装,干扰了线粒体电子传递链功能,进而触发免疫原性细胞死亡(图4)。
更进一步的,结合不可逆电穿孔的破膜技术,LMPs可进一步促进损伤相关分子模式和肿瘤抗原向细胞膜外部释放,激活树突状细胞成熟和记忆性T细胞分化,形成长效抗肿瘤免疫记忆。研究团队通过复挑战实验也验证了“肿瘤特异性免疫记忆”的建立:联合治疗可诱导更强的肿瘤特异性T细胞反应,并在同源肿瘤再接种中获得显著保护;而对异源肿瘤并未表现出同等保护,提示该记忆应答具有抗原特异性。这为“局部治疗-系统免疫-长期记忆”的闭环提供了证据支撑,也凸显了该策略在“原位疫苗化”方向的潜力。
相关研究工作以Liquid Metal Nanoparticles-Mediated Mitochondrial Damage Enhances Immunogenic Cell Death for Cancer Vaccine Therapy为题发表在Advanced Materials。论文第一作者为中国科学院理化技术研究所和北京中医药大学联合培养生戚瑜瑕、于中阳,及中国科学院理化技术研究所研究生张杰,中国科学院理化技术研究所饶伟研究员、国家纳米科学中心王磊研究员及北京中医药大学东方医院周天主任医师为本文通讯作者。
本研究工作得到了低温科学与技术全国重点实验室的大力支持,团队通过生物传热传质、材料学和医学等多学科交叉融通形成科研合力,阐明了可变形液态金属纳米颗粒“由小变大、由外入内、由静变动”的物理化学作用机制,也为解决纳米材料在单细胞中的滞留与渗透矛盾提供了全新的研究思路。

图1.液态金属纳米颗粒介导线粒体损伤并放大ICD、协同IRE实现肿瘤疫苗式免疫治疗的总体策略

图2. 靶向与自组装协同提升细胞摄取并定位至溶酶体
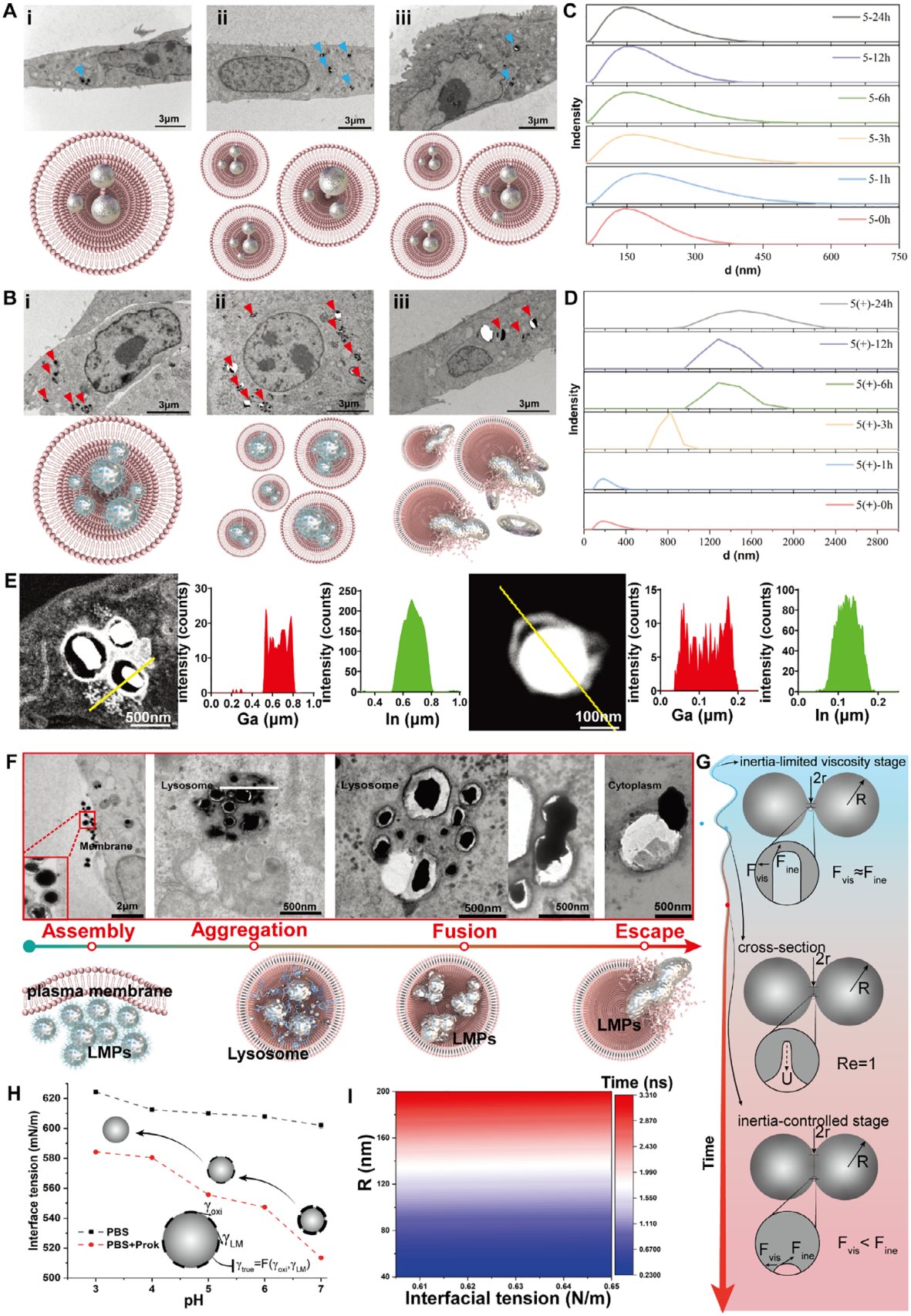
图3. LMPs在溶酶体内自融合增大并部分逃逸至胞质

图4. Ga³⁺铁替代导致线粒体损伤并放大ICD与先天免疫信号
论文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202520580
新闻中心